لو انت ضايع ف الكيمياء جبتلك الحل باذن الله ...
معاك مذكرة مراجعه ليلة الامتحان الورق مكتوب بخط كبير غير مضغوط وهتريحك وتنجز معاك فيها
تجميع الافكار ... المسائل ... الرسومات .... التعليلات ... الافكار ... الرسومات البيانية
وبعد م تخلصها لازم تهتم بالاجزاء الجاية من كل فصل ودا نصيحة خاصة من خبير الكيمياء الاستاذ محمد الضوي
هناخدهم باب باب ...
يجب ليله الامتحان التاكيد علي :
بالنسبه للباب الاول
1- حفظ استخدام واحد لكل عنصر من عناصر السلسله الانتقاليه الاولي
2- الرجوع للتوزيع الالكتروني لعناصر السلسله الاولي ومعرفه الشاذ منها فالتوزيع .
3- ضروره المقارنات والتي تشمل
مقارنه بين بين خامات الحديد الاربعه .
مقارنه بين الفرن العالي وفرن مدركس .
مقارنه بين انواع السبائك الثلاثه .
مقارنه بين الماده البارا والدايا مغناطيسيه .
مقارنه بين سلسلتين من السلاسل الانتقاليه الاربعه .
4- ضروره التاكيد علي وجود نوعين من الافران هما
افران الاختزال وافران انتاج الحديد الصلب .
5- مفاتيح التحويلات : اي سوال يبدأ ب
* كربونات حديد II - اوكسالات حديد II -
هيدروكسيد حديد III - كبريتات حديد II يجب التسخين اولا وبعدها ناخذ الماده الناتجه ونكمل بها .
* يمكن تحويل جميع اكاسيد الحديد الي حديد باختزالها باحدى العوام المختزله اما اول اكسيد الكربون اوالهيدروجين.
في درجه حراره اعلى من 700
* عند السؤال مبتدئا ب كلوريد الحديد III فانه يضاف اليه اولا هيدروكسيد الامونيوم ليتكون هيدروكسيد الحديد III والذي عند تسخينه يتكون اكسيد الحديد III .
* تفاعل الحديد مع الكلور يعطي كلوريد الحديد III وعند تفاعل الحديد مع بخار الماء يتكون اكسيد حديد مغناطيسي والحديد مع الاحماض المخففه يعطي الملح الثنائي للحديد والحديد مع الكبريت يصنع الملح الثنائي
* لتحويل الحديد الى هيدروكسيد الحديد III يتم تفاعل الحديد مع الكلور اولا ليتكون كلوريد الحديد III ثم يضاف محلول لقلوي وليكن هيدروكسيد الامونيوم.
6- ضروره الرجوع للالوان والنشاط الحفزي لعناصر السلسله الاولي .
7- كيف تميز بين :
حمض كبريتيك مركز واخر مخفف .
حمض نيتريك مركز وكبريتيك مركز .
اكسيد حديد II و III .
االحديد واكسيد الحديد المغناطيسي .
8- ضروره الرجوع لتعليلات الباب .
..................
بالنسبه للباب الثاني :
1- الأسس العلميه والتي تشمل :
الاساس العلمي للكشف عن الشقوق الحامضيه
الاساس العلمي للكشف عن الشقوق القاعديه .
الاساس العلمي للتحليل الكمي الحجمي .
الاساس العلمي للتحليل الكمي الكتلي .
الاساس العلمي لطريقه التطاير .
الاساس العلمي لطريقه الترسيب .
2- اهم المقارنات : مقارنيه بين
الادله الاربعه
انواع التفاعلات في المعايره وهي تفاعلات ( التعادل - الاكسده والاختزال - الترسيب )
طريقه التطاير والترسيب
3- المسائل
*مساله اجباري عن (معايره - تطاير - ترسيب )
*مساله عن حساب النسبه المئويه
4- مهم سوال كيف تميز بين وهنا يجب حفظ كل الكواشف وكذالك المعادلات .
5- ضروره الرجوع لتعريفات الباب
.............
بالنسبه للباب الثالث :
1- المقارنات الهامه والتي تشمل :
مقارنه بين
الالكتروليتات القويه والضعيفه
التفاعلات التامه والانعكاسيه
الاتزان الكيميائي والايوني
التاين التام والضعيف
التعادل والتميؤ
2- كلمه اتزان ذكرت اربعه مرات في ( نظام متزن - الاتزان الكيميائي- الاتزان الايوني - حاله الاتزان ) من الضروري تعريف كل واحده منهم .
3- تجارب مهمه فى الباب واحده منهم علي الاقل في الامتحان :
تجربه تبين
اثر مساحه السطح علي معدل التفاعل
تاثير التركيز علي تفاعل متزن
اثر الحراره علي تفاعل متزن
اثر التخفيف علي التاين
4- ضروري العوده للتميؤ فلا يخلو الامتحان من التميؤ
5- مسائل علي ( اجباري واحد علي الاقل في الامتحان )
حساب ثابت الاتزان - درجه التفكك - تركيز ايون الهيدرونيوم- الاس الهيدروجيني - حاصل الاذابه .
6- ضروره العوده لتعريفات الباب
7- ضروره التدريب علي قاعده لوشاتيليه .
8- الرسم البياني المعبر عن التفاعلات التامه والانعكاسيه .
9- ضروره الرجوع لتعليلات الباب .
10- ضروره الرجوع للاثباتات والتي منها
(قانون استفالد - حساب تركيز ايون الهيدرونيوم - حساب تركيز ايون الهيدروكسيد )
...................
بالنسبه للباب الرابع :
1- مقارنات هامه والتي منها : مقارنه بين
الاكسده والاختزال .
الخلايا الجلفانيه والالكتروليتيه .
الموصلات الالكترونيه والالكتروليتيه .
خليه الزئبق وخليه الوقود .
بطاريه المركم الرصاصي وايون الليثيوم
الغطاء الانودي والكاثودي
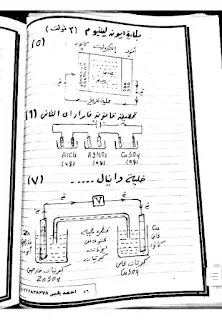
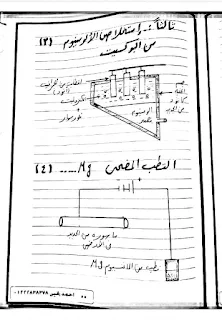
2- الرسومات الهامه في الباب ( قطب الهيدروجين القياسي - المركم الرصاصي - خليه الوقود - طلاء ابريق من النحاس بالفضه - تنقيه النحاس - استخلاص الالمنيوم )
3- يوجد ثلاث تطبيقات هامه علي الخليه التحليليه (واحده منهم في الامتحان ) وهي
كيفيه طلاء ابريق من النحاس بالفضه
كيفيه تنقيه ساق نحاسيه بها شوائب
كيفيه استخلاص الالمونيوم .
4- يوجد اربع تطبيقات علي الخلايا الجلفانيه اثنان منهم خلايا اوليه (خليه الوقود وخليه الازئبق ) واثنان خلايا ثانويه ( المركم الرصاصي وبطاريه ايون الليثيوم )
5- ضروره الرجوع لميكانيكيه صدأ الحديد
6- مسائل الباب ( مسالتين في الامتحان في الكهربيه )
ومن اشهر المسائل
مساله علي حساب القوه الدافعه الكهربيه
مساله علي قوانين فراداي
7- ضروره الرجوع للمصطلحات والتعليلات الخاصه بالباب .
...........
الباب الخامس الكيمياء العضوية
1- مقارنات هامه بين :
المركبات العضويه والغير عضويه
هيدره الايثين والايثاين
التحلل الحراري لكبريتات الايثيل الهيدروجينيه والتحلل المائي لها .
تفاعل ماء البروم مع الايثين والايثاين .
صيغ جزيئيه وبنائيه .
2- تجربه الكشف عن الكريون والهيدروجين .
3- تحضير غاز الميثان والايثين والايثاين في المعمل
(رسم الجهاز مع كتابه المعادله ) .
4- الاستخدامات والصيغ البنائيه لكل من
الكلوروفورم - الهالوثان - الفريونات - الايثيلين جليكول - 1-1-1ثلاثي كلورو ايثان - بولي ايثيلين - بولي بروبيلين - بولي ڤاينيل كلوريد - التفلون - الاسيتالدهيد
5- كيف تميز بين
مركب عضوي وغير عضوي
مركب مشبع ( الكان ) واخر غير مشبع ( الكين - الكاين )
6- ادوار العلماء ( برازليوس - فوهلر - ماركونيكوف - باير )
7- ضروره العوده لاسس تسميه الايوباك .للمركبات العضويه
8- الرجوع للمصطلحات العلميه والتعليلات الخاصه بالعضويه .
9- مهم جدا قاعده ماركونيكوف (الغني يزداد غنا )
10- تحويلات العضويه (بين بالمعادلات كيف تحصل علي غالبا معادلتين ) مثل
الحصول علي اسود الكربون او الغاز المائي من اسيتات الصوديوم
الحصول علي الايثيلين جليكول من الايثانول
الحصول علي الايثاين من اسيتات الصوديوم
الحصول علي اسيتالدهيد من كربيد الكالسيوم
الحصول على حمض الاستيك او الكحول الايثيلي من الاستيليتن .
الحصول على كلوروفورم من كلوريد ميثيل .
الحصول على بوروميد ايثيل من ايثانول .
.............
متنساش تشيرهم لاصحابك وتوصلهم لهم
متنساش تعمل لنا follow وتساعدنا نفيدك ونساعدك دايما
معاك مذكرة مراجعه ليلة الامتحان الورق مكتوب بخط كبير غير مضغوط وهتريحك وتنجز معاك فيها
تجميع الافكار ... المسائل ... الرسومات .... التعليلات ... الافكار ... الرسومات البيانية
وبعد م تخلصها لازم تهتم بالاجزاء الجاية من كل فصل ودا نصيحة خاصة من خبير الكيمياء الاستاذ محمد الضوي
هناخدهم باب باب ...
يجب ليله الامتحان التاكيد علي :
بالنسبه للباب الاول
1- حفظ استخدام واحد لكل عنصر من عناصر السلسله الانتقاليه الاولي
2- الرجوع للتوزيع الالكتروني لعناصر السلسله الاولي ومعرفه الشاذ منها فالتوزيع .
3- ضروره المقارنات والتي تشمل
مقارنه بين بين خامات الحديد الاربعه .
مقارنه بين الفرن العالي وفرن مدركس .
مقارنه بين انواع السبائك الثلاثه .
مقارنه بين الماده البارا والدايا مغناطيسيه .
مقارنه بين سلسلتين من السلاسل الانتقاليه الاربعه .
4- ضروره التاكيد علي وجود نوعين من الافران هما
افران الاختزال وافران انتاج الحديد الصلب .
5- مفاتيح التحويلات : اي سوال يبدأ ب
* كربونات حديد II - اوكسالات حديد II -
هيدروكسيد حديد III - كبريتات حديد II يجب التسخين اولا وبعدها ناخذ الماده الناتجه ونكمل بها .
* يمكن تحويل جميع اكاسيد الحديد الي حديد باختزالها باحدى العوام المختزله اما اول اكسيد الكربون اوالهيدروجين.
في درجه حراره اعلى من 700
* عند السؤال مبتدئا ب كلوريد الحديد III فانه يضاف اليه اولا هيدروكسيد الامونيوم ليتكون هيدروكسيد الحديد III والذي عند تسخينه يتكون اكسيد الحديد III .
* تفاعل الحديد مع الكلور يعطي كلوريد الحديد III وعند تفاعل الحديد مع بخار الماء يتكون اكسيد حديد مغناطيسي والحديد مع الاحماض المخففه يعطي الملح الثنائي للحديد والحديد مع الكبريت يصنع الملح الثنائي
* لتحويل الحديد الى هيدروكسيد الحديد III يتم تفاعل الحديد مع الكلور اولا ليتكون كلوريد الحديد III ثم يضاف محلول لقلوي وليكن هيدروكسيد الامونيوم.
6- ضروره الرجوع للالوان والنشاط الحفزي لعناصر السلسله الاولي .
7- كيف تميز بين :
حمض كبريتيك مركز واخر مخفف .
حمض نيتريك مركز وكبريتيك مركز .
اكسيد حديد II و III .
االحديد واكسيد الحديد المغناطيسي .
8- ضروره الرجوع لتعليلات الباب .
..................
بالنسبه للباب الثاني :
1- الأسس العلميه والتي تشمل :
الاساس العلمي للكشف عن الشقوق الحامضيه
الاساس العلمي للكشف عن الشقوق القاعديه .
الاساس العلمي للتحليل الكمي الحجمي .
الاساس العلمي للتحليل الكمي الكتلي .
الاساس العلمي لطريقه التطاير .
الاساس العلمي لطريقه الترسيب .
2- اهم المقارنات : مقارنيه بين
الادله الاربعه
انواع التفاعلات في المعايره وهي تفاعلات ( التعادل - الاكسده والاختزال - الترسيب )
طريقه التطاير والترسيب
3- المسائل
*مساله اجباري عن (معايره - تطاير - ترسيب )
*مساله عن حساب النسبه المئويه
4- مهم سوال كيف تميز بين وهنا يجب حفظ كل الكواشف وكذالك المعادلات .
5- ضروره الرجوع لتعريفات الباب
.............
بالنسبه للباب الثالث :
1- المقارنات الهامه والتي تشمل :
مقارنه بين
الالكتروليتات القويه والضعيفه
التفاعلات التامه والانعكاسيه
الاتزان الكيميائي والايوني
التاين التام والضعيف
التعادل والتميؤ
2- كلمه اتزان ذكرت اربعه مرات في ( نظام متزن - الاتزان الكيميائي- الاتزان الايوني - حاله الاتزان ) من الضروري تعريف كل واحده منهم .
3- تجارب مهمه فى الباب واحده منهم علي الاقل في الامتحان :
تجربه تبين
اثر مساحه السطح علي معدل التفاعل
تاثير التركيز علي تفاعل متزن
اثر الحراره علي تفاعل متزن
اثر التخفيف علي التاين
4- ضروري العوده للتميؤ فلا يخلو الامتحان من التميؤ
5- مسائل علي ( اجباري واحد علي الاقل في الامتحان )
حساب ثابت الاتزان - درجه التفكك - تركيز ايون الهيدرونيوم- الاس الهيدروجيني - حاصل الاذابه .
6- ضروره العوده لتعريفات الباب
7- ضروره التدريب علي قاعده لوشاتيليه .
8- الرسم البياني المعبر عن التفاعلات التامه والانعكاسيه .
9- ضروره الرجوع لتعليلات الباب .
10- ضروره الرجوع للاثباتات والتي منها
(قانون استفالد - حساب تركيز ايون الهيدرونيوم - حساب تركيز ايون الهيدروكسيد )
...................
بالنسبه للباب الرابع :
1- مقارنات هامه والتي منها : مقارنه بين
الاكسده والاختزال .
الخلايا الجلفانيه والالكتروليتيه .
الموصلات الالكترونيه والالكتروليتيه .
خليه الزئبق وخليه الوقود .
بطاريه المركم الرصاصي وايون الليثيوم
الغطاء الانودي والكاثودي
2- الرسومات الهامه في الباب ( قطب الهيدروجين القياسي - المركم الرصاصي - خليه الوقود - طلاء ابريق من النحاس بالفضه - تنقيه النحاس - استخلاص الالمنيوم )
3- يوجد ثلاث تطبيقات هامه علي الخليه التحليليه (واحده منهم في الامتحان ) وهي
كيفيه طلاء ابريق من النحاس بالفضه
كيفيه تنقيه ساق نحاسيه بها شوائب
كيفيه استخلاص الالمونيوم .
4- يوجد اربع تطبيقات علي الخلايا الجلفانيه اثنان منهم خلايا اوليه (خليه الوقود وخليه الازئبق ) واثنان خلايا ثانويه ( المركم الرصاصي وبطاريه ايون الليثيوم )
5- ضروره الرجوع لميكانيكيه صدأ الحديد
6- مسائل الباب ( مسالتين في الامتحان في الكهربيه )
ومن اشهر المسائل
مساله علي حساب القوه الدافعه الكهربيه
مساله علي قوانين فراداي
7- ضروره الرجوع للمصطلحات والتعليلات الخاصه بالباب .
...........
الباب الخامس الكيمياء العضوية
1- مقارنات هامه بين :
المركبات العضويه والغير عضويه
هيدره الايثين والايثاين
التحلل الحراري لكبريتات الايثيل الهيدروجينيه والتحلل المائي لها .
تفاعل ماء البروم مع الايثين والايثاين .
صيغ جزيئيه وبنائيه .
2- تجربه الكشف عن الكريون والهيدروجين .
3- تحضير غاز الميثان والايثين والايثاين في المعمل
(رسم الجهاز مع كتابه المعادله ) .
4- الاستخدامات والصيغ البنائيه لكل من
الكلوروفورم - الهالوثان - الفريونات - الايثيلين جليكول - 1-1-1ثلاثي كلورو ايثان - بولي ايثيلين - بولي بروبيلين - بولي ڤاينيل كلوريد - التفلون - الاسيتالدهيد
5- كيف تميز بين
مركب عضوي وغير عضوي
مركب مشبع ( الكان ) واخر غير مشبع ( الكين - الكاين )
6- ادوار العلماء ( برازليوس - فوهلر - ماركونيكوف - باير )
7- ضروره العوده لاسس تسميه الايوباك .للمركبات العضويه
8- الرجوع للمصطلحات العلميه والتعليلات الخاصه بالعضويه .
9- مهم جدا قاعده ماركونيكوف (الغني يزداد غنا )
10- تحويلات العضويه (بين بالمعادلات كيف تحصل علي غالبا معادلتين ) مثل
الحصول علي اسود الكربون او الغاز المائي من اسيتات الصوديوم
الحصول علي الايثيلين جليكول من الايثانول
الحصول علي الايثاين من اسيتات الصوديوم
الحصول علي اسيتالدهيد من كربيد الكالسيوم
الحصول على حمض الاستيك او الكحول الايثيلي من الاستيليتن .
الحصول على كلوروفورم من كلوريد ميثيل .
الحصول على بوروميد ايثيل من ايثانول .
.............
متنساش تشيرهم لاصحابك وتوصلهم لهم
متنساش تعمل لنا follow وتساعدنا نفيدك ونساعدك دايما
 |
| مذكرة مراجعه ليلة الامتحان ( مادة الكيمياء ) لطلاب ثانوى عام |
 |
| مذكرة مراجعه ليلة الامتحان ( مادة الكيمياء ) لطلاب ثانوى عام |